Vírus de Epstein-Barr
O que é o virus da doença do beijo.
 |
A maioria das pessoas se infecta com este vírus e obtém imunidade adquirida. As crianças ficam suscetíveis ao vírus tão cedo quanto a proteção dos anticorpos maternos desaparece.
VIROLOGÍA
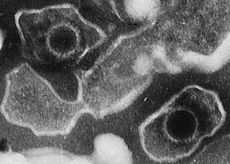
Estrutura e genoma
Uma partícula madura do vírus de Epstein-Barr tem um diâmetro entre 120 nm e 180 nm. Ele consiste de uma cadeia dupla de DNA linear fechada por uma cápside proteica. A cápside está rodeada por um tegumento de proteínas, que por sua vez está rodeado por um invólucro lipídico.
O genoma do vírus é de aproximadamente 192000 pares de bases de comprimento e contem cerca de 85 genes. O invólucro viral se integra com glicoproteínas essenciais para a entrada do vírus na célula.
Os ensaios de laboratório e em animais realizados no ano 2000 demonstraram que tanto o antagonismo da inibição do crescimento intermediada por RA e a promoção da proliferação de LCL se inverteram de maneira eficiente mediante o receptor de glicocorticoides (GR) antagonista RU486.
Tropismo
O termo tropismo viral refere-se à capacidade que um vírus tem para infectar determinados tipos de célula. O vírus de Epstein-Barr pode infectar diferentes tipos de células, incluindo as células B e as células epiteliais. Em certos casos, pode infectar as células T, as células assassinas naturais (Nk), e as células musculares lisas.
Os complexos glicoproteicos virais de três partes de gHglgp42 intermediam a fusão de membranas das células B, enquanto que os complexos de duas partes gHgl intermediam a fusão de membranas de células epiteliais. Os vírus de Epstein-Barr que se produzem nas células B tem números baixos de complexos gHglgp42 quando os complexos de três partes interagem com HLA de classe II no reticulo endoplasmático e são destruídos. Em contraste, os vírus de Epstein-Barr produzidos a partir de células epiteliais são ricos em complexos de três partes, porque estas células não tem MHC de classe II. Como resultado, os vírus produzidos a partir de células B são mais infecciosos para as células epiteliais, e os vírus produzidos a partir das células epiteliais são mais infecciosos para as células B.
Ciclo de Replicação
Entrada na Célula
O vírus de Epstein-Barr pode infectar tanto á células B como á células epiteliais. Os mecanismos para entrar nestas duas células são diferentes. Para entrar nas células B, a glicoproteína viral gp350 se une ao receptor celular CD21 (também conhecido como CR2). Em seguida, a glicoproteína viral gp42 interage com moléculas celulares MHC de classe II. Isto desencadeia a fusão do invólucro viral com a membrana da célula epitelial, que permite ao vírus entrar na célula B.
Para entrar nas células epiteliais, a proteína viral BMRF-2 interage com as integrinas B1 celulares. Então, a proteína viral gH/gL interage com as integrinas celulares avB6/8 (são proteínas de adesão presentes na membrana). Isto desencadeia a fusão do invólucro viral com a membrana da célula epitelial, o que permite ao vírus entrar na célula epitelial. Ao contrário da entrada em células B, a entrada em células epiteliais na realidade é impedida pela glicoproteína viral gp42.
Uma vez que o vírus entre na célula, a cápside viral se dissolve e o genoma viral é transportado ao núcleo da célula.
Replicação do Ciclo Lítico
O ciclo lítico, ou infecção produtiva, tem como resultado da produção de viriões infecciosos. O vírus de Epstein-Barr pode submeter-se a replicação do ciclo lítico nas células B assim como nas células epiteliais. Nas células B, a replicação do ciclo lítico só tem lugar normalmente depois da reativação a partir da latência. Nas células epiteliais, a replicação do ciclo lítico muitas vezes se dá diretamente após entrada do vírus.
Para que haja replicação do ciclo lítico, o genoma viral deve ser linear. O genoma do vírus latente é circular, portanto se deve linearizar o genoma no processo de reativação. Durante a replicação do ciclo lítico, o DNA polimerase viral é responsável pela copia do genoma viral. Isto contrasta com a latência, em que o DNA polimerase da célula hospedeira copia o genoma viral.
Os produtos génicos líticos são produzidos em três etapas consecutivas: precoce-imediata, precoce e tardia.
- Produtos gênicos líticos precoce-imediatos. Atuam como transativadores, aumentando a expressão de genes líticos mais tarde. Estes produtos gênicos incluem o BZLF1 (também conhecido como Zta e ZEBRA) e o BRLF1.
- Produtos gênicos líticos precoces. Tem muito mais funções, tais como a replicação, o metabolismo, e o bloqueio do processamento de antígenos. Os primeiros produtos dos genes líticos precoces incluem o BNLF2.
- Produtos gênicos líticos tardios. Tendem a ser proteínas com funções estruturais, como a VCA, que forma a cápside viral. Outros produtos genéticos líticos tardios, tais como o BCRF1, ajudam ao vírus a evitar o sistema imune.
Ao contrário da replicação do ciclo lítico de muitos outros vírus, a do vírus de Epstein-Barr inevitavelmente não conduz a quebra da célula hospedeira devido ao fato de que os viriões são produzidos por gemação a partir da célula infectada. As proteínas do ciclo lítico inclue, o gp350 e o gp110.
Latência
Ao contrario da replicação do ciclo lítico, a latência não resulta na produção de viriões. Em seu lugar, o genoma do vírus se circulariza, reside no núcleo da célula como um epissomo, e é copiado pelo DNA polimerase celular. Em latência, só uma parte dos genes do vírus se expressam.
O vírus latente expressa seus genes em um dos três padrões conhecidos como programas de latência. O vírus latente pode persistir de forma latente dentro das células B e das células epiteliais, mas são possíveis diferentes programas de latência nos dois tipos de células.
O vírus de Epstein-Barr pode apresentar um dos seguintes três programas de latência: Latência I, Latência II ou Latência III. Cada programa de latência conduz a produção de um conjunto limitado e distinto de proteínas virais e RNA virais.
| Gene expressado | EBNA-1 | EBNA-2 | EBNA-3 A | EBNA-3 B | EBNA-3 C | EBNA-LP | LMP-1 | LMP-2 A | LMP-2 B | EBER |
|---|---|---|---|---|---|---|---|---|---|---|
| Produto | Proteína | Proteína | Proteína | Proteína | Proteína | Proteína | Proteína | Proteína | Proteína | ncARNs |
| Latência I | + | - | - | - | - | - | - | - | - | + |
| Latência II | + | - | - | - | - | + | + | + | + | + |
| Latência III | + | + | + | + | + | + | + | + | + | + |
Teoricamente há um programa em que se apaga toda a expressão de proteínas virais (Latência 0).
Dentro das células B, os três programas de latência são possíveis. O vírus latente dentro das células B normalmente passam da Latência III, a latência II e logo a latência I. Cada etapa de latência influi unicamente no comportamento das células B. Ao infectar uma célula B nova em repouso, o vírus entra em latência III. O conjunto de proteínas e RNAs produzidos na Latência III transforma a célula B em uma explosão de proliferação (também conhecida como ativação de células B). Mais tarde, o vírus restringe sua expressão gênica e entra em Latência II. O conjunto mais limitado de proteínas e RNAs produzidos em Latência II induz a célula B a diferenciar-se em uma célula B de memoria. Finalmente, o vírus restringe a expressão do gene ainda mais entra em Latência I. A expressão de EBNA-1 permite que o genoma do vírus se replique quando a célula B de memoria se divide.
Dentro das células epiteliais, só é possível a Latência II. Na infecção primaria, o vírus de Epstein-Barr se replica nas células epiteliais orofaríngeas e estabelece as infecções em Latência III, II, e I, nos linfócitos B. A infecção dos linfócitos B pelo vírus latente é necessária para a persistência do vírus, para a replicação posterior nas células epiteliais e para a liberação do vírus infeccioso na saliva. As infecções dos linfócitos B por parte do vírus em Latência III e II, a infecção das células epiteliais orais pelo vírus em latência II e a infecção em Latência II das células NK ou das células T, podem dar lugar a doenças malignas, caracterizadas pela presença uniforme do genoma do vírus e expressão genica.
Reativação
O vírus latente nas células B pode ser reativado para mudar a replicação do ciclo lítico. Sabe-se que isso acontece in vivo, mas não se sabe com precisão como se desencadeia. In vitro, o vírus latente nas células B pode ser reativado mediante a estimulação do receptor de células B, já a reativação in vivo provavelmente tem lugar quando as células B infectadas de forma latente respondem a infecções não relacionadas. In vitro, o vírus latente das células B também pode ser reativado mediante o tratamento das células com butirato de sódio o TPA.
Transformação dos linfócitos B
Quando o vírus de Epstein-Barr infecta as células B in vitro, as linhagens celulares linfoblastoides que eventualmente emergem são capazes de um crescimento indefinido. A transformação do crescimento destas linhagens celulares é a consequência da expressão da proteína viral.
Os genes EBNA-2, EBNA-3 e LMP-1 são essenciais para a transformação, enquanto que o EBNA-LP e EBER não são.
Teoricamente, considera-se que, após uma infecção natural com o vírus, o mesmo executa alguns ou todos os seus programas de expressão gênica para estabelecer uma infecção persistente. Dada à ausência inicial de imunidade do hospedeiro, o ciclo lítico produz grandes quantidades de vírus para infectar a outros (presumidamente) linfócitos B dentro do hospedeiro.
Os programas latentes reprogramam e subvertem os linfócitos B infectados para que proliferem e produzam células infectadas nos locais em que o vírus presumidamente persiste. Finalmente, quando desenvolve a imunidade do hospedeiro, o vírus persiste apagando a maioria de seus genes (ou possivelmente todos), reativando-se só de vez em quando para produzir novos viriões. Um equilíbrio finalmente é alcançado entre a reativação viral ocasional e a vigilância imune do hospedeiro, eliminando as células que ativam a expressão gênica viral.
O local de persistência do vírus pode ser a medula óssea. Os pacientes positivos para o vírus Epstein-Barr após ter sua própria medula óssea substituída pela de um doador que seja negativo para o vírus, por sua vez, os resultados dos testes dão negativos depois do transplante.
Antígenos Latentes
Todas as proteínas nucleares do virus de Epstein-Barr são produzidas mediante corte e emenda alternativa de uma transcrição primária, sejam os promotores Cp ou os Wp no extremo esquerdo do genoma (na nomenclatura convencional). Os genes se ordenam dentro do genoma na sequencia: EBNA-LP/EBNA-2/EBNA-3A/EBNA-3B/EBNA-3C/EBNA-1.
O codão de iniciação da região de codificação EBNA-LP é criado por um corte e emenda alternativo da transcrição da proteína nuclear. Na ausência deste códon de iniciação, a sequência EBNA-2/ EBNA-3A/EBNA-3B/EBNA-3C/EBNA-1 se expressa dependendo de qual destes genes se emenda alternativamente na transcrição.
Proteínas / Genes
| Proteína / Gene / antígeno | Etapa | Descrição |
|---|---|---|
| EBNA-1 | latente+lítico | A proteína de EBNA-1 se une a uma origem de replicação (oriP) no genoma viral e intermedia a replicação e a participação do epissomo durante a divisão da célula hospedeira. É a única proteína viral expressa durante a latência grupo I. |
| EBNA-2 | latente+lítico | El EBNA-2 é o principal transativador viral. |
| EBNA-3 | latente+lítico | Estes genes se unem a uma proteína RBP-J do hospedeiro. |
| LMP-1 | latente | LMP-1 é uma proteína transmembrana de seis lapsos que também é essencial para a transformação do crescimento intermediada pelo vírus. |
| LMP-2 | latente | LMP-2A e LMP2B são proteínas transmembrana que atuam para bloquear a sinalização da tirosina quinase. |
| EBER | latente | EBER-1 y EBER-2 são pequenos RNA nucleares, que se unem a determinadas partículas de nucleoproteína, permitindo a união a PKR (dsRNA dependente da proteína quinase serina/treonina), inibindo assim sua função. As partículas EBER- também induzem a produção de IL-10 que aumenta o crescimento e inibe as células T citotóxicas. |
| miRNAs | latente | Os microRNAs do vírus são codificados mediante duas transcrições, um jogo no gene BART e outro conjunto próximo ao grupo BHRF1. Os três miRNAs BHRF1 são expressos durante a latência tipo III, enquanto que o grande grupo de miRNAs BART (até 20 miRNAs) são expressos durante a latência do tipo II. As funções destes miRNAs é desconhecida. |
| EBV-EA | lítico | antígeno precoce |
| EBV-MA | lítico | antígeno de membrana |
| EBV-VCA | lítico | antígeno da cápside viral |
| EBV-AN | lítico | nuclease alcalina |
Subtipos do vírus de Epstein-Barr
Os vírus de Epstein-Barr (EBV) podem ser divididos em dois principais tipos: tipo 1 e tipo 2. Estes dois subtipos tem diferentes genes EBNA-3. Como resultado, os dois subtipos diferem em suas capacidades de transformação e de reativação. O tipo 1 é dominante em quase todo o mundo, mas os dois tipos prevalecem igualmente na África.
Se pode distinguir o tipo 1 do tipo 2 cortando o genoma viral com uma enzima de restrição e comparando os padrões de digestão resultantes mediante eletroforese em gel.
PAPEL NA DOENÇA
O vírus de Epstein-Barr tem sido implicado em varias doenças que incluem a mononucleose infecciosa (doença do beijo), o linfoma de Burkitt, o linfoma de Hodgkin, o carcinoma naso-faríngeo e a esclerose múltipla.
HISTÓRIA
O vírus de Epstein-Barr deve seu nome a Michael Anthony Epstein, professor emérito da Universidade de Bristol e a Yvonne Barr, que descobriu e documentou o vírus.
Em 1961, Michael Anthony Epstein, patologista e especialista em microscopia electrônica, assistiu a uma conferência intitulada "Os cânceres mais comuns em crianças da África tropical - Uma síndrome não reconhecida até agora”. Esta conferência, de Denis Burkitt Parsons, um cirurgião que operava em Uganda, foi a descrição da “variante endêmica” (forma pediátrica) da doença que leva seu nome.
Em 1963, um espécime foi enviado da Uganda ao Hospital de Middlesex para ser cultivado. As partículas virais foram identificadas nas células cultivadas, e os resultados foram publicados no The Lancet em 1964 por Epstein, Bert Achong, e Barr. As linhagens celulares foram enviadas a Werner y Gertrude Henle no Hospital de Crianças da Filadélfia, que desenvolveu os marcadores sorológicos. Em 1967, um técnico de seu laboratório se infectou com mononucleose e com isso foram capazes de comparar uma amostra armazenada de soro, exibindo os anticorpos para o vírus cultivado.
Em 1968, foi descoberto que o vírus pode imortalizar diretamente as células B depois da infecção, imitando alguns tipos de infecções relacionadas, e confirmando a relação entre o vírus e a mononucleose infecciosa.
INVESTIGAÇÃO
O vírus de Epstein-Barr é relativamente complexo e ainda não totalmente compreendido. Laboratórios de todo o mundo continuam estudando o vírus e desenvolvendo novas formas de tratar as doenças que provoca. Uma maneira popular de estudar este vírus in vitro é o uso de cromossomas artificiais bacterianos.
O vírus de Epstein-Barr e seu vírus irmão KSHV podem ser mantidos e manipulados em laboratório em latência continua. Enquanto se assume que muitos vírus tem essa propriedade durante a infecção do seu hospedeiro natural, eles não tem um sistema de fácil manejo para estudar esta parte do ciclo de vida viral. Os estudos de genômica do vírus tem sido capazes de explorar a reativação do ciclo lítico e a regulagem do epissomo viral latente.